Kooperationsprojekt vereint Fachexpertisen
In Zusammenarbeit mit dem Deutschen Zentrum für Infektionsforschung (DZIF) und dem Helmholtz-Zentrum für Infektionsforschung (HZI) optimieren die Wissenschaftler*innen den Produktionsprozess des Naturstoffes und entwickeln die Substanz in Richtung Zulassung als Antibiotikum weiter. Das Projekt hat mittlerweile rund 7,5 Millionen Euro öffentliche Fördergelder eingeworben. Derzeit laufen präklinische Versuche und die Vorbereitungen für den Produktionsprozess für ein qualitativ hochwertiges Corallopyronin A nach Arzneimittelstandard (GMP). Eine Herstellerfirma, die das Antibiotikum in großem Maßstab auch für klinische Prüfungen produzieren kann, wird derzeit gesucht. Die PROvendis GmbH unterstützt die Wissenschaftler*innen seit Projektbeginn bei der Patentierung und dem Abschluss von Verträgen mit Forschungspartnern und Unternehmen.
Im Interview mit PROvendis spricht Prof. Achim Hörauf, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie (IMMIP) des Universitätsklinikums Bonn, über die Meilensteine des Projekts und die Bedeutung von Schutzrechten im Prozess der Wirkstoffentwicklung.
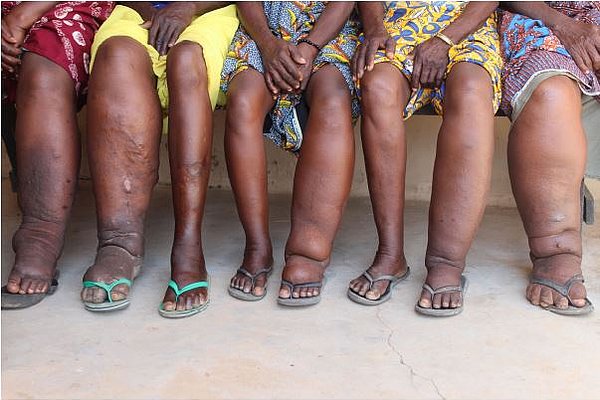
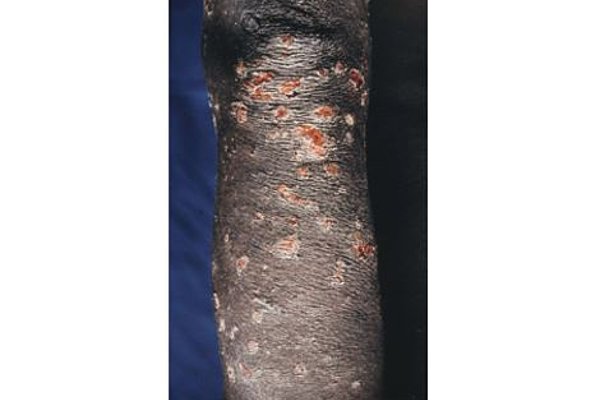
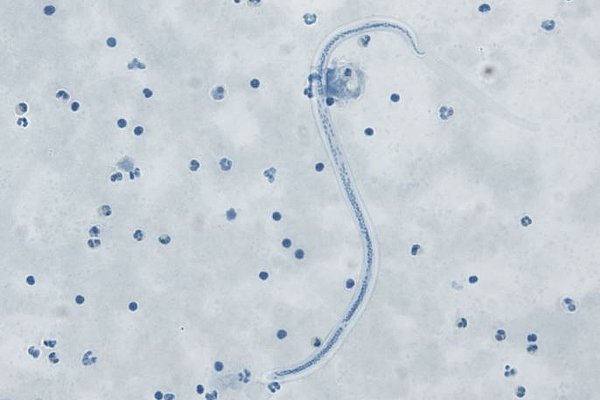
Herr Prof. Hörauf, Sie sind führender Experte für vernachlässigte Tropenkrankheiten, insbesondere solche, die durch parasitäre Würmer ausgelöst werden. Wie ordnen Sie die Bedeutung eines neuen Antibiotikums in diesem Bereich ein?
Prof. Hörauf: Der Einsatz von Antibiotika gegen die vernachlässigten Tropenkrankheiten ist ein Paradigmenwandel, da bisherige Medikamente die in Massenbehandlungen (MDAs) eingesetzt werden, die adulten Filarien nicht abtöten können. Die neuen Antibiotika sollen nun eine Therapiezeitdauer von 2 Wochen oder weniger ermöglichen, wodurch die Gabe an die Bevölkerung stark vereinfacht wird.
Welche Bedeutung hat die schutzrechtliche Sicherung von Forschungsergebnissen im Prozess der Wirkstoffentwicklung?
Prof. Hörauf: Nachdem wir die ersten Male Corallopyronin A erfolgreich in vivo gegen Würmer eingesetzt haben, wurde uns schnell klar, dass wir hier einen tollen Naturstoff haben, den wir für diese Indikation patentieren wollen. Der IP-Schutz ist dabei essenziell für die Gewinnung von Partnern aus der pharmazeutischen Industrie, die entscheidend für den späteren Vertrieb sind.
PROvendis hat mittlerweile über 30 Verträge im Projekt mitbegleitet. Welche verschiedenen Verträge spielen in einem Projekt mit so vielen Kooperationspartnern eine Rolle?
Prof. Hörauf: PROvendis hat uns neben der Sicherung der IP-Rechte bzw. Klarstellung der Sublizenzierung bei den verschiedenen Partnern auch hinsichtlich Geheimhaltungsverträgen und Verträgen zum Materialtransfer beratend unterstützt. Da PROvendis über viele Mitarbeiter mit verschiedenen Expertisen verfügt, fühlen wir uns hinsichtlich der IP-Rechte sowohl fachlich (Biologie, IT) als auch juristisch sehr gut vertreten. Die Rechtsabteilung des UKB arbeitet z.B. eng mit den Juristen von PROvendis zusammen, wenn es um die Abstimmung der verschiedenen Verträge geht. Das ist für uns als Wissenschaftler toll, direkt ein doppeltes Team im Hintergrund zu haben.
Was ist beim Austausch mit Unternehmen zu beachten, die Interesse haben, die Erfindung zu nutzen bzw. eine Lizenz zu nehmen?
Prof. Hörauf: Vor detaillierten Gesprächen wird immer zuerst eine Geheimhaltungsvereinbarung (CDA) geschlossen, ähnlich wie bei wissenschaftlichen Kollaborationen. Zusätzlich informieren wir uns in welchem Feld die Firma tätig ist und bereiten uns auf mögliche Fragen zu Marktanteilen oder Verwendungsgebieten vor.
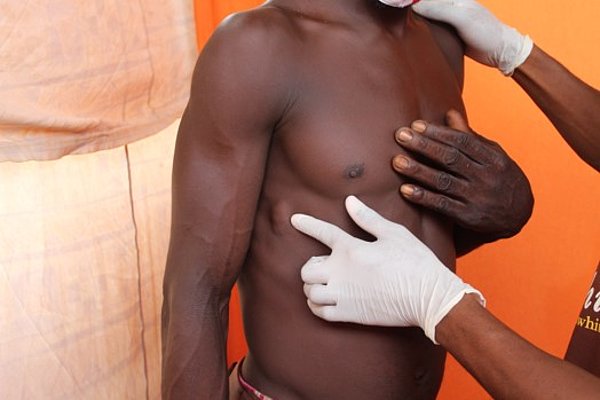
Sie sind jetzt in der Endphase der präklinischen Testung von Corallopyronin A. Was sind die nächsten Schritte?
Prof. Hörauf: Die wichtigsten Schritte im nächsten Jahr sind die sogenannte GLP Toxikologie und Sicherheitspharmakologie. Dazu müssen wir in diesem Jahr noch den „Dose range“ und „Max tolerated dose“ in der zweiten Spezies, einem Nicht-Nagetier (Hund) bestimmen, wie von der regulatorischen Behörde vorgeschrieben. Von großer Bedeutung für das Projekt ist weiterhin der Transfer zu einem GMP-zertifizierten Lohnhersteller, der das für diese Studien notwendige Material unter GMP-Bedingungen (Good Manufacturing Practice) im großen Maßstab herstellen kann. Im Anschluss daran werden wir den Antrag für die klinische Prüfung stellen. Ein weiterer Schritt, um Corallopyronin A für die Verwendung im Menschen zulassen zu können.
Im Rückblick auf die Zeit seit der Patentanmeldung 2011 – vor nun mehr als 10 Jahren: Welche neuen Erkenntnisse und Erfahrungen haben Sie gewonnen, mit denen Sie zuvor als Wissenschaftler nicht vertraut waren oder die Ihnen unbekannt waren?
Prof. Hörauf: Seit der Patentanmeldung ist uns schnell bewusst geworden, wieviel IP wert sein kann. Ein Projekt in dieser Größenordnung kann nur im Verbund erfolgreich sein. Durch die Kooperation innerhalb des DZIF mit den Wissenschaftlern vom HZI, ist uns ein solcher Verbund gelungen. Wir vereinen die Fachexpertisen für die Produktion (Erzeugung eines heterologen Produzentenstammes, Fermentation und Verfahrenstechnik, HZI), die Entwicklung einer Formulierung (Erhöhung der Bioverfügbarkeit und Stabilität, Pharmazeutische Technologie, Universität Bonn) und die Effizienz im Tiermodell (UKB). Der Verwaltungsapparat des UKB musste sich mit EU-weiten Verfahren für größeren Ausschreibungen auseinandersetzen, wozu zusätzlich Expertise einer Fachkanzlei eingeholt wurde. Generell muss man, wenn man eine Substanz erfolgreich auf den Markt zu bringen möchte, viel externe Fachexpertise einkaufen (z. B. Toxikologe und sachkundige Person), was man frühzeitig in der Budgetplanung berücksichtigen sollte.
Meilensteine und Ausblick
2015 Erteilung erstes US-Patent, Universität Bonn
2017 Erteilung zweites US-Patent, Universität Bonn
2017 Erteilung Europäisches Patent, Universität Bonn
2017 Beginn präklinischer Versuche
2018 Erteilung EU-Patent zur heterologen Produktion von Corallopyronin A, HZI
2020 Hochskalierung des Produktionsprozesses, 300 L Maßstab
2020 Anmeldung Formulierungspatent, Universität Bonn
2021 Erste in vivo toxikologischen Versuche in Ratten
2022 Hochskalierung des Produktionsprozesses in industriellen Maßstab, 15.000L
2023 Fertigstellung der präklinischen Entwicklungsphase
2024 Beginn klinische Phase I
Weitere Informationen
↗ zum Technologieangebot CorA as anthelmintic (Human filariasis)
↗ Website des Helmholtz-Zentrums für Infektionsforschung (HZI)
↗ Website des Kumasi Centre for Collaborative Research (KCCR)
↗ Website der Drugs for Neglected Diseases initiative (DNDi)